リバルエン®LAパッチ
製剤・安定性について
有効成分であるリバスチグミンを高分子マトリックス中に含有し、放出制御膜を含む複数の層で構成する多層マトリックスパッチである。放出制御膜により長期間にわたって製剤からの薬物の放出を一定速度で制御している。[1]
[1]リバルエンLAパッチ25.92mg/51.84mg IF Ⅳ.製剤に関する項目 1.剤形の項

電子添文に「使用するまでは小袋内で保管すること。」と記載しています[1]ので、前もって開封した製剤を処方することはお勧めしていません。
参考として、無包装状態における安定性試験結果は以下の通りです。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
[2]リバルエンLAパッチ25.92mg/51.84mg IF Ⅳ.製剤に関する項目 6.製剤の各種条件下における安定性の項
リバルエンLAパッチ25.92mg/リバルエンLAパッチ51.84mg この表は横にスクロールできます。
| 試験区分 | 保存条件 | 保存期間 | 保存(包装)形態 | 結果 |
|---|---|---|---|---|
| 長期保存試験 | 25℃、60%RH | 24箇月 | 分包品 | 規格内 |
| 加速試験 | 40℃、75%RH | 6箇月 | 分包品 | 規格内 |
| 苛酷試験 | 50℃ | 3箇月 | 分包品 | 規格内 |
| 25℃、75%RH | 3箇月 | 無包装 | 規格内 | |
| 光安定性試験 | 120万lx・hr、200W・hr/m2 | - | 無包装 | 規格内 |
試験項目:性状、確認試験、純度試験(類縁物質)、粘着性、放出性、定量法等
用法及び用量
1回1枚貼付し、1枚を3~4日ごとに1回、1週間に2回、決めた曜日に貼りかえます。
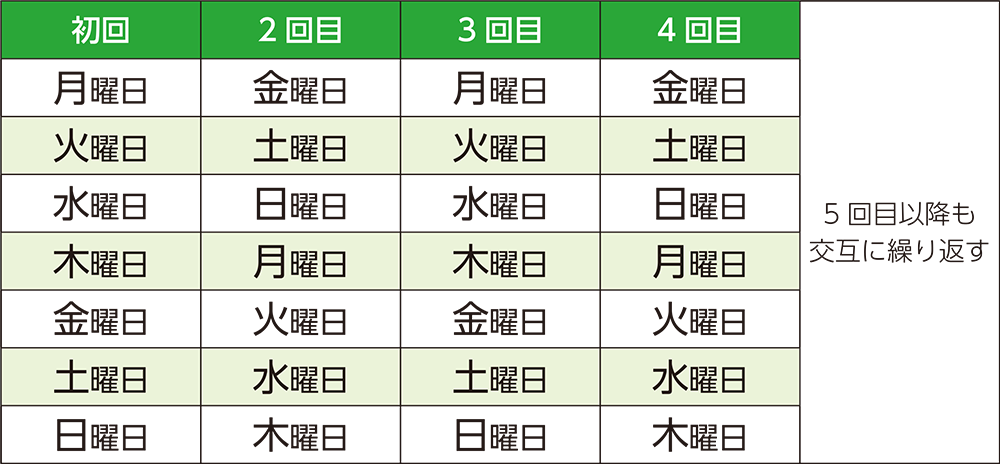
<参考>
6.用法及び用量[1]
通常、成人にはリバスチグミンとして1回25.92mgから開始し、原則として4週後に維持量である1回51.84mgに増量する。
本剤は背部、上腕部、胸部のいずれかの正常で健康な皮膚に貼付する。原則として開始時は4日間貼付し、1枚を3~4日ごとに1回(週2回)貼り替える。
7.用法及び用量に関連する注意
7.1 本剤の1回あたりの貼付枚数は原則1枚とし、貼付期間は4日間を超えないこと。週2回行う本剤の貼り替えのタイミング(曜日)は原則固定すること。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
リバルエンLAパッチを背部、上腕部、胸部以外に貼付した場合の有効性や安全性は確認されていません。承認されている用法及び用量に従って貼付をお願いします。[1]
<参考>
リバスチグミンテープ18mg製剤を上背部、胸部、腹部、大腿部及び上腕部に24時間貼付したとき、AUCinfは上背部、胸部、及び上腕部でそれぞれ128、128、及び118ng・hr/mLと同程度であったが、腹部及び大腿部では103及び91.0ng・hr/mLと低かった(外国人のデータ)[2]
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
[2]Journal of Clinical Pharmacology 47, 471-478, 2007
承認された用法及び用量とは異なりますので、複数枚貼付することは避けてください。
電子添文の記載は以下のとおりです。[1]
7. 用法及び用量に関連する注意
7.1 本剤の1回あたりの貼付枚数は原則1枚とし、貼付期間は4日間を超えないこと。週2回行う本剤の貼り替えのタイミング(曜日)は原則固定すること。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
本剤の貼付により皮膚症状があらわれることがあるため、貼付箇所を毎回変更してください。
同一箇所に貼付・除去を繰り返した場合、皮膚角質層の剥離等が生じ、血中濃度が増加するおそれがあります。[1]
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
使用上の注意
はがれそうなときは、再度手で押さえて貼ってください。押さえてもはがれそうなときは、市販の医療用テープで固定してください。
完全にはがれたときは、新しい薬に貼り替えてください。その後はあらかじめ決めた曜日に新しい薬に貼り替えてください。[1]
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
貼り忘れに気づいたときは、気づいた時点で新しい薬を貼ってください。決して2回分のパッチを一度に貼らないでください。次回からは、通常のスケジュールで貼り替えてください。
休薬期間が4日以上の場合は、原則として初回貼付用量(25.92mg)から投与を再開してください。投与再開後は再開時の用量を2週間以上投与し、忍容性が良好であることを確認した上で増量してください。
休薬期間が4日未満の場合、休薬前と同じ用量または休薬前に忍容であった用量で投与を再開してください。[1]
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
過量投与時の症状、処置は以下の通りです。[1]
貼り替えの際には、先に貼付している製剤を除去したことを十分に確認してください。
<症状>
外国における経口投与及び国内外における経皮投与による過量投与例では、嘔吐、悪心、下痢、腹痛、めまい、振戦、頭痛、失神、傾眠、錯乱状態、幻覚、多汗症、徐脈、高血圧、けん怠感及び縮瞳等が認められている。重篤例では、筋力低下、痙攣、呼吸停止などが発現し、致死的な転帰に至る可能性がある。
<処置>
過量投与時には、速やかに本剤をすべて除去し、その後24時間はそれ以上の貼付を行わないでください。重度の悪心、嘔吐には制吐剤の使用を考慮してください。また、大量の過量投与時には、アトロピン硫酸塩水和物を解毒剤として使用できます。最初にアトロピン硫酸塩水和物として1~2mgを静脈内投与し、臨床反応に応じて投与を追加してください。解毒剤としてスコポラミンの使用は避けてください。
<参考>
8. 重要な基本的注意
8.5 本剤の貼り替えの際、貼付している製剤を除去せずに新たな製剤を貼付して過量投与となり、重篤な副作用が発現するおそれがある。貼り替えの際は先に貼付している製剤を除去したことを十分確認するよう患者及び介護者等に指導すること。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
承認されている用法及び用量を適切に遵守できないため、パッチを半分に切るなど切断することは推奨していません。
十分な有効性、安全性が得られない可能性があります。
本剤の取り扱い時に手に付着した成分の刺激性により、眼症状が起きることを防ぐため、本剤を扱った後は手を眼に触れず、手を洗ってください。[1][2]
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
[2]リバルエンLAパッチ25.92mg/51.84mg IF Ⅷ.安全性(使用上の注意等)に関する項目 11.適用上の注意の項
国内第Ⅲ相試験において、入浴の制限を設けず、有効性及び安全性に関して二重盲検比較試験を実施しました。[1]
24週時の本剤の接着性は、「90%以上」の接着率が80.7%(117/145例)で、大部分の症例で良好な接着率が認められています。接着率が「80%以上」、「70%以上」、「60%以上」の接着率であった割合は、それぞれ1.4%(2/145例)、1.4%(2/145例)、0.7%(1/145例)で、わずかに剥離が認められています。一方で「50%未満接着若しくは完全剥離」の接着率も15.9%(23/145例)と一定の割合で認められています。なお、試験期間中は製剤が剥離しかけた場合は、固定用テープを使用し剥離を防止しましたが、接着性評価時は貼付面積が50%以下になった場合にのみ固定用テープを使用しました。 [2]
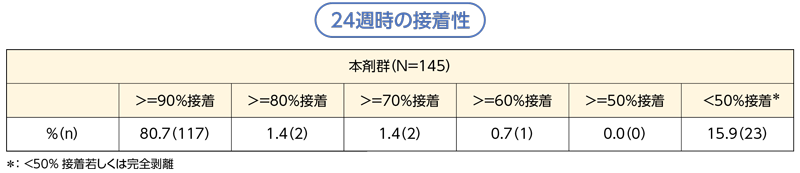
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
[2]リバルエンLAパッチ25.92mg/51.84mg IF Ⅴ.治療に関する項目 5.臨床成績の項
クリーム、ローション、パウダー、軟膏などをぬったばかりの場所は剥がれやすくなります。乾いた場所に貼ってください。
<参考>
14. 適用上の注意[1]
14.2.4 貼付する箇所にクリーム、ローション又はパウダーを塗布しないこと。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
安全性
主な副作用として、皮膚症状や消化器症状が報告されています。
(国内第Ⅲ相試験での主な副作用)[1]
二重盲検期の副作用の発現割合は本剤群で75.1%(136/181例)であった。主な副作用は、適用部位紅斑30.4%(55/181例)、適用部位そう痒感27.6%(50/181例)及び接触皮膚炎17.1%(31/181例)等であった。
二重盲検期を完了した軽度及び中等度のアルツハイマー型認知症患者を対象に本剤の51.84mg製剤を週2回(4日間と3日間の交互)で28週間投与する非盲検継続投与試験(本剤群は二重盲検期と併せて52週間投与、リバスチグミン貼付剤群は本剤の51.84mg製剤に切り替えて28週間投与)を実施した。本剤投与期間中の副作用の発現割合は本剤群(52週間)で77.3%(140/181例)、切り替え群(28週間)で58.6%(85/145例)であった。主な副作用は、本剤群で適用部位紅斑30.4%(55/181例)、適用部位そう痒感28.2%(51/181例)及び接触皮膚炎17.1%(31/181例)であり、切り替え群で適用部位紅斑30.3%(44/145例)、適用部位そう痒感20.0%(29/145例)及び接触皮膚炎12.4%(18/145例)であった。
[1]リバルエンLAパッチ25.92mg/51.84mg 電子添文
薬物動態
健康成人に本剤を1日目、5日目及び8日目に計3回反復投与して血漿中未変化体濃度を測定したとき、半減期(T1/2)は8.06±2.73時間でした。[1]
[1]社内資料 : 反復投与(海外試験) (2025年3月27日承認、申請資料概要2.7.2.2)
保険
本剤は、投薬(あるいは投与)期間に関する制限は定められていません。
その他
使用済みのパッチにはまだ成分が残っているため、接着面を内側にして折りたたみ、子どもの手の届かないところや目につかないところに捨ててください。
 医療関係者向けサイト
医療関係者向けサイト