リバルエン®LAパッチ
開発の経緯
リバルエン®LAパッチはスイスのLuye Pharma Switzerland AG社により開発されたリバスチグミンを有効成分として含有する持続放出性経皮吸収型製剤(パッチ剤)である。1週間に2回貼付することにより、アルツハイマー型認知症治療薬として効果を示す。
アルツハイマー型認知症は、臨床的には認知機能の低下、神経病理学的には老人斑と神経原線維変化を特徴とする進行性の神経変性疾患であり、認知機能の低下とコリン作動性神経機能の低下は相関する。リバスチグミンはアセチルコリンの分解に関わるアセチルコリンエステラーゼ及びブチリルコリンエステラーゼの阻害作用に基づき、脳内アセチルコリン量を増加させ、脳内コリン作動性神経機能を賦活する。
本邦ではリバスチグミンを有効成分とする1日1回貼付のパッチ剤が2011年4月に承認されている。貼付剤は服薬状況が可視化され、服薬管理を行う介護者等の負担軽減が期待され、アドヒアランスをよくするための工夫の一つとして考えられている。
一方、アルツハイマー型認知症治療薬は1日1回~2回の投薬が必要であり、投薬頻度を低減することが服薬管理における更なる負担軽減につながると期待される。また投薬頻度を週2回とすることで、固定した曜日での投薬が可能となるためスケジュール管理が容易になり、アドヒアランス向上にも寄与することが期待される。
これらのことを勘案し、東和薬品は1週間に2回貼付するパッチ剤を導入し、軽度及び中等度アルツハイマー型認知症患者を対象とし1日1回貼付のパッチ剤を対照薬とした二重盲検比較試験を実施し非劣性が検証され、2025年3月に新剤形医薬品として「リバルエン®LAパッチ25.92mg」及び「リバルエン®LAパッチ51.84mg」の承認を取得し、同年5月に発売した。
治療学的特性
- 1 週間に2回の貼付投与で、軽度及び中等度のアルツハイマー型認知症患者の認知症症状の進行を抑制する。 臨床成績はこちら
- 脳内アセチルコリンエステラーゼとブチリルコリンエステラーゼを阻害し、アセチルコリンレベルを増加させる(ラット)。
- 重大な副作用として、QT延長、心筋梗塞、徐脈、房室ブロック、洞不全症候群、脳卒中、痙攣発作、食道破裂を伴う重度の嘔吐、胃潰瘍、十二指腸潰瘍、胃腸出血、肝炎、失神、幻覚、激越、せん妄、錯乱、脱水が報告されている。 詳細はこちら
- 貼付部位に適用部位そう痒感、適用部位紅斑、接触皮膚炎等の障害があらわれることがある。 詳細はこちら
製剤学的特性
日本初の持続放出性アルツハイマー型認知症治療用貼付剤
日本初の持続放出性のアルツハイマー型認知症治療用貼付剤である(軽度及び中等度のアルツハイマー型認知症における認知症症状の進行抑制)。
持続放出性のパッチ剤
リバスチグミンを有効成分として含有する持続放出性経皮吸収型製剤(パッチ剤)であり、定常状態におけるCmax,96-264、Cmin,96-264、Ctau_264及びAUC96-264から1日1回貼付製剤と同程度の曝露量を示すことが確認されている(海外データ)。詳細はこちら
有効成分であるリバスチグミンを高分子マトリックス中に含有し、放出制御膜を含む複数の層で構成する多層マトリックスパッチである。放出制御膜により長期間にわたって製剤からの薬物の放出を一定速度で制御している。

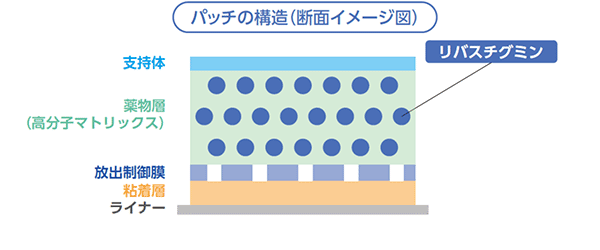
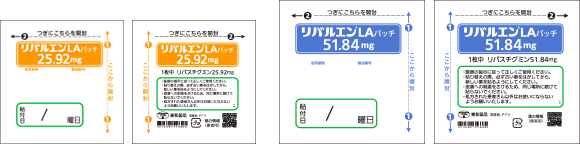
誤投与防止の取り組み 規格間の区別
本剤には、含量の異なる2製剤があり、誤投与防止のため支持体に用量を記載している。
また、個装箱及び包装袋は用量ごとに色を変えて区別している。
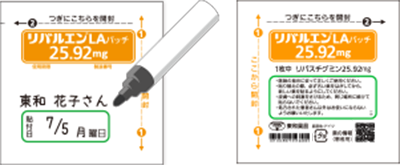
書き込みが可能な支持体
支持体は不透過性のポリエステル製であり、曜日や日付を書き込むことができる。

包装袋
包装袋には、貼付予定の日付と曜日を書き込むことができる。
また、患者名を記入するスペースを設けている。
本剤の使用説明書にアクセスできるQRコードを表示している 。
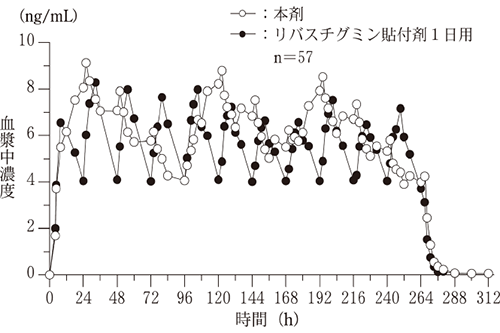
薬物動態
反復投与試験(健康成人・外国人データ)1)
外国人健康成人57例を対象に本剤の51.84mg製剤を週2回(4日間と3日間の交互)又はリバスチグミン貼付剤(1日1回貼付)の18mg製剤を1日1回、上背部に11日間反復経皮投与したときの定常状態におけるPKパラメータは下表のとおりであった。また、リバスチグミン貼付剤に対する本剤の幾何平均値の比[90%信頼区間]は、Cmax,96-264で1.051[0.984,1.124]、Cmin,96-264で1.078[0.978,1.189]、Ctau_264で1.086[1.018,1.158]及びAUC96-264で1.136[1.073,1.203]であり、いずれも同程度であったことから、51.84mg製剤の週2回投与がリバスチグミン貼付剤の18mg製剤の1日1回投与と同程度の曝露量を示すことが確認された。
薬物動態パラメータこの表は横にスクロールできます。
| Cmax,96-264 (ng/mL) |
Cmin,96-264 (ng/mL) |
Ctau_264 (ng/mL) |
AUC96-264 (ng・h/mL) |
|
|---|---|---|---|---|
| 本剤 | 9.92±2.99 | 3.03±1.13 | 4.06±1.31 | 1060±340 |
| リバスチグミン貼付剤 (1日1回貼付) |
9.75±3.92 | 2.87±1.15 | 3.73±1.11 | 937±330 |
平均値±標準偏差
反復投与試験(軽度及び中等度アルツハイマー型認知症患者)2)
軽度及び中等度アルツハイマー型認知症患者に51.84mg製剤(最初の4週間は25.92mg製剤)を週2回投与したときの8、16及び24週時における血漿中リバスチグミン濃度の範囲は、リバスチグミン貼付剤(1日1回貼付)の18mg製剤(最初の4週間は9mg製剤)を1日1回貼付したときと同程度であった。
1)社内資料 : 反復投与(海外試験) (2025年3月27日承認、申請資料概要2.7.2.2)
2)社内資料 : 反復投与(国内試験) (2025年3月27日承認、申請資料概要2.7.2.2)
臨床薬理試験
海外第Ⅰ相試験 2剤2期クロスオーバー試験(海外データ)3)
健康成人男性58名を対象として、本剤の51.84mg製剤を週2回(4日間と3日間の交互)、又はリバスチグミン貼付剤1日用(1日1回貼付)の18mg製剤を1日1回、それぞれ上背部に11日間反復貼付した。
本剤群での副作用は適用部位掻痒感が10.34%(6/58例)、頭痛が8.62%(5/58例)、適用部位紅斑が6.90%(4/58例)、適用部位丘疹及び睡眠障害が各5.17%(3/58例)、悪心、嘔吐及び初期不眠症が各3.45%(2/58例)であった。
試験を完了した57名において両剤のトラフ値である96、168、264時間後の血漿中ブチリルコリンエステラーゼ(以下、BuChE)活性阻害率の平均値は両群でほぼ同程度であり、ベースラインと比較して30%程度の阻害率であった。また、貼付開始96~268時間の期間中、両剤共通のトラフ値以外の測定ポイントでの血漿中BuChE活性阻害率の平均値は、本剤群の方が高い推移を示しており、血漿中リバスチグミン濃度と相関していることが考えられた。
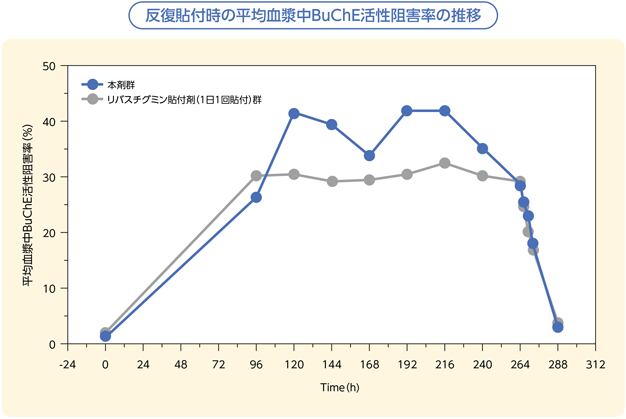
3)社内資料:海外第Ⅰ相試験 2剤2期クロスオーバー試験(C_30410_P1_05試験)
臨床成績
国内第Ⅲ相試験
試験概要
- 試験デザイン
- 多施設共同、無作為化、並行群間、二重盲検比較及び継続投与非盲検試験
- 対象
- 軽度及び中等度アルツハイマー型認知症患者
二重盲検期登録例:362 例(本剤群 181例、リバスチグミン貼付剤1日用(1日1回貼付)群 181例)
非盲検期登録例:286例(本剤群 141例、切り替え群145例)
- 対象
-
軽度及び中等度アルツハイマー型認知症患者
二重盲検期登録例: 362 例(本剤群 181例、リバスチグミン貼付剤1日用群 181例)<二重盲検期>
[有効性解析対象例数]
FAS:354例(本剤群 176例、リバスチグミン貼付剤1日用群178例)
PPS:342例(本剤群172例、リバスチグミン貼付剤1日用群170例)
[安全性解析対象例数]
362例(本剤群 181例、リバスチグミン貼付剤1日用群 181例)<非盲検期>
PPS:274例(本剤群136例、切り替え群138例)
[安全性解析対象例数]:286例(本剤群141例、切り替え群145例) - 方法
-
<二重盲検期>
観察期(単盲検)は4週間とし、本剤(プラセボ)及びリバスチグミン貼付剤1日用(プラセボ)を4週間投与した。二重盲検期は24週間とし、コリンエステラーゼ阻害薬の投与歴の有無、メマンチン塩酸塩の投与歴の有無を層別因子として、本剤群又はリバスチグミン貼付剤1日用群のいずれかに1:1の割合で無作為に割付け24週時に主要評価を行った。
本剤群では本剤の51.84mg製剤(最初の4週間は25.92mg製剤)を3日毎又は4日毎に1回1枚を背部、上腕部、胸部に貼付した。リバスチグミン貼付剤群ではリバスチグミン貼付剤(1日1回貼付)の18mg製剤(最初の4週間は9mg製剤)を、1日1回1枚を背部、上腕部、胸部に貼付した。<非盲検期>
非盲検期は28週間とし、本剤を非盲検で投与した。本剤の51.84mg製剤を3日毎又は4日毎に1回1枚を背部、上腕部、胸部に貼付した。 - 評価項目
-
[有効性]
<二重盲検期>
【主要評価項目】認知機能:24週時におけるADAS-Jcogのベースラインからの変化量
【副次評価項目】認知機能:各時点(8~24週)におけるADAS-Jcog並びに8週及び16週におけるADAS-Jcogのベースラインからの変化量
全般臨床症状評価:各時点(8~24週)におけるABC認知症スケールの合計スコア(ドメインごとの合計及び13項目の合計)及びTDD(three dimensional distance)並びにそれぞれのベースラインからの変化量<非盲検期>
認知機能:各時点(28~52週)におけるADAS-Jcog及びベースライン及び24週時からの変化量
全般臨床症状評価:各時点(28~52週)におけるABC認知症スケール(ドメインごとの合計及び13項目の合計)及びTDD並びにそれぞれのベースラインと24週時からの変化量[安全性]
<二重盲検期>
有害事象、臨床検査値、バイタルサイン、体重、12誘導心電図、皮膚刺激性、接着性<非盲検期>
有害事象、臨床検査値、バイタルサイン、体重、12誘導心電図、アンケート調査、1日用からの切り替え時の安全性も併せて評価した - 解析方法
- [有効性]
<二重盲検期>
【主要評価項目】<主要解析>
ベースラインのADAS-Jcogを共変量、治療群を独立変数とした反復測定混合効果モデル解析(MMRM)を用い、ADAS-Jcogのベースラインから24週時までの変化量を評価し、24週時における本剤群とリバスチグミン貼付剤1日用群の最小二乗平均値の差(本剤-リバスチグミンテープ)の点推定値、標準誤差及び両側95%信頼区間を算出した。信頼区間の上限が予め規定した非劣性限界値1.1を下回ったときに、本剤群はリバスチグミン貼付剤1日用群に対して非劣性であると判定した。
有効性
本剤群は、リバスチグミン貼付剤(1日1回貼付)群に対する非劣性が検証された。
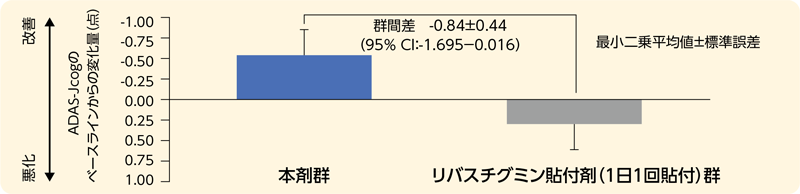
投与24週時におけるADAS-Jcogのベースラインからの変化量(認知機能検査)
| 本剤群 | リバスチグミン貼付剤 (1日1回貼付)群 | |
|---|---|---|
| ベースラインa) | 21.13±5.99 (176例) |
20.82±6.74 (178例) |
| 投与24週時a) | 20.07±7.17 (144例) |
20.49±7.72 (147例) |
| ベースラインからの変化量b),c) | -0.54[-1.150,0.065] | 0.30[-0.306,0.900] |
| 変化量の群間差b),c) | -0.84[-1.695,0.016] | |
- a) 平均値±標準偏差
- b) 最小二乗平均値[95%信頼区間]
- c) 投与群、評価時期、投与群と評価時期の交互作用を固定効果、ベースライン値を共変量としたMMRM(分散共分散構造はToeplitz)
安全性
二重盲検期の副作用の発現割合は本剤群で75.1%(136/181例)であった。主な副作用は、適用部位紅斑30.4%(55/181例)、適用部位そう痒感27.6%(50/181例)及び接触皮膚炎17.1%(31/181例)等であった。重篤な副作用の発現割合は、1.1%(2/181例)で、その内訳は心房粗動及び悪心が各0.6%(1/181例)であった。投与中止に至った副作用の発現割合は、7.7%(14/181例)で、その内訳は接触皮膚炎及び適用部位そう痒感が各1.7%(3/181例)、食欲減退,適用部位紅斑及び適用部位浮腫が各1.1%(2/181例)、心房粗動、悪心、嘔吐、適用部位皮膚炎、心電図QT延長及び体重減少が各0.6%(1/181例)であった。死亡に至った副作用の発現割合は、0.0%(0/181例)であった。
二重盲検期を完了した軽度及び中等度のアルツハイマー型認知症患者を対象に本剤の51.84mg製剤を週2回(4日間と3日間の交互)で28週間投与する非盲検継続投与試験(本剤群は二重盲検期と併せて52週間投与、リバスチグミン貼付剤群は本剤の51.84mg製剤に切り替えて28週間投与)を実施した。本剤投与期間中の副作用の発現割合は本剤群(52週間)で77.3%(140/181例)、切り替え群(28週間)で58.6%(85/145例)であった。主な副作用は、本剤群で適用部位紅斑30.4%(55/181例)、適用部位そう痒感28.2%(51/181例)及び接触皮膚炎17.1%(31/181例)であり、切り替え群で適用部位紅斑30.3%(44/145例)、適用部位そう痒感20.0%(29/145例)及び接触皮膚炎12.4%(18/145例)であった。
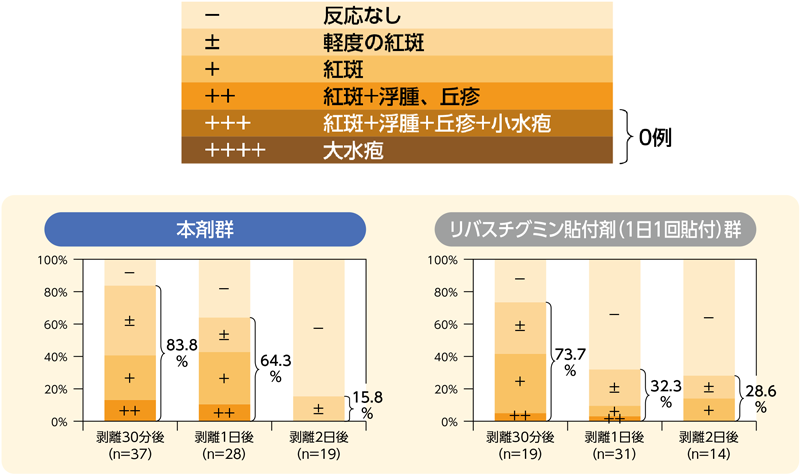
皮膚刺激性
パッチテスト判定基準を用いて評価した皮膚刺激性の頻度集計を表に示した。
いずれの群でも「+++」及び「++++」は認められなかった。皮膚刺激性スコアの反応なし以外の割合は、本剤群では剥離30分後83.8%(31/37例)、1日後64.3%(18/28例)、2日後15.8%(3/19例)であり、リバスチグミン貼付剤群でも剥離30分後73.7%(14/19例)、1日後32.3%(10/31例)、2日後28.6%(4/14例)と経時的に低下した。
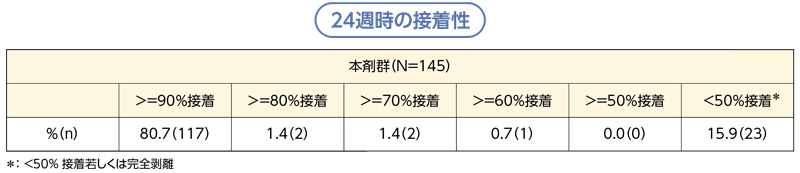
接着性
24週時の本剤群の接着性は、「90%以上」の接着率が80.7%(117/145例)であり、大部分の症例で良好な接着率が認められた。
(試験期間中は製剤が剥離しかけた場合は、固定用テープを使用し剥離を防止したが、接着性評価時は貼付面積が50%以下になった場合にのみ固定用テープを使用した)
4)社内資料:国内第Ⅲ相試験_軽度及び中等度アルツハイマー型認知症を対象とした無作為化二重盲検並行群間比較試験(承認時評価資料)
介護者へのアンケート調査
国内第Ⅲ相試験における52週時に介護者へアンケート調査を実施した。
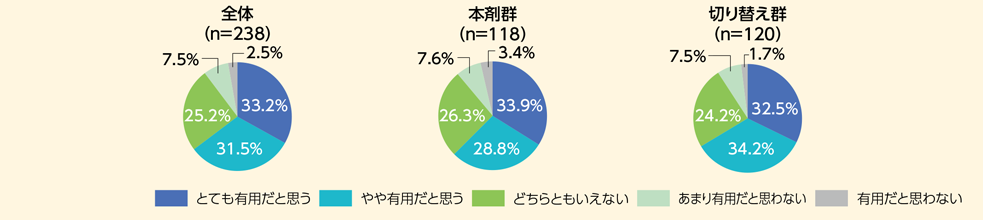
本剤週2回投与の有用性について確認したところ、「とても有用だと思う」または「やや有用だと思う」と回答した割合が、本剤群で62.7%(74/118例)、切り替え群*で66.7%(80/120例)であった。その理由として、最も多かったのが「貼り替えの頻度が減ることにより、他の作業に時間を使うことができる」であり、本剤群で49.2%(58/118例)、切り替え群で54.2%(65/120例)であった。
一方、「あまり有用だと思わない」または「有用だと思わない」と回答した割合が本剤群で11.0%(13/118例)、切り替え群で9.2%(11/120例)であった。その理由として、最も多かったのが「剥がれていないことの確認に手間がかかるから又は剝がれの対応に手間がかかる」であり、本剤群で7.6%(9/118例)、切り替え群で5.8%(7/120例)であった。
*24週以降、リバスチグミン貼付剤(1日1回貼付)から本剤に切り替えた被験者
- Q1 1日1回製剤と比較して週2回製剤は有用ですか?
- Q2-1 Q1の理由を教えてください。<Q1で「有用」と答えられた方のみ>(複数回答可)
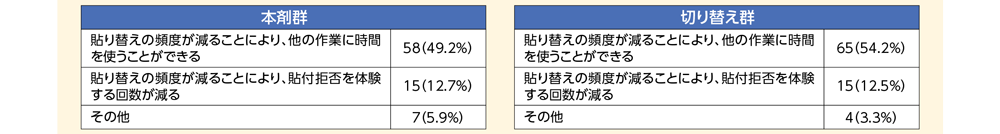
- Q2-2 Q1の理由を教えてください。<Q1で「有用でない」と答えられた方のみ>(複数回答可)

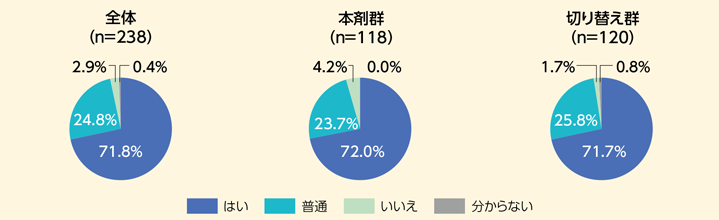
- Q3 週2回製剤は貼りやすかったですか?
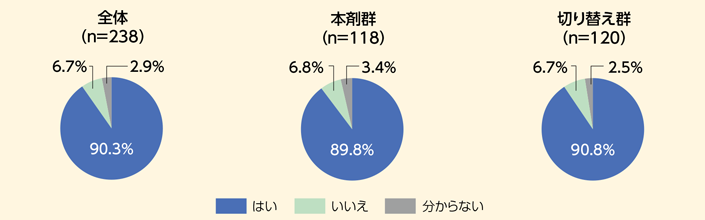
- Q4 週2回製剤は剥がしやすかったですか?
社内資料 : 国内第Ⅲ相試験_軽度及び中等度アルツハイマー型認知症を対象とした無作為化二重盲検並行群間比較試験(承認時評価資料)から作成
 医療関係者向けサイト
医療関係者向けサイト