製造管理・品質管理
東和薬品は、「品質は企業の命である」という確固たる信念のもと、医薬品の開発から製造、流通に至るまで一貫した品質保証体制を構築し、高品質で安全性の高い医薬品の提供に努めています。
例えば、製品の安定性モニタリングを行い、出荷後の製品に潜在的な品質リスクがない事を継続して確認することで品質を保証しています。また、定期的な内部監査の実施により、品質システムの運用上の弱点が認められれば、直ちに改善検討するなど、品質保証体制の強化に努めています。さらに、全社員が品質方針を理解した上で、業務を遂行できるよう、定期的な研修や教育プログラムを実施しています。
真摯な姿勢で日々の業務に取り組み、患者さんが安心して治療を受けられ、医療関係者が信頼して使用できる製品を提供し続けることを目指しています。
東和薬品の品質方針
東和薬品グループは、優れた製品とサービスを創造することによって、人々の健康に貢献することをお約束します。
- 常に患者さんを第一に考え、必要とされる確かな品質の医薬品及び情報を提供します。
- 最新の国際標準に適合する品質保証体制を構築し、関連法律と規制要求事項を遵守し、適切な製造管理と品質管理を実践します。
- 製造現場から経営トップまで、全ての社員が一体となって、品質優先の価値観を浸透させていきます。
- 最新の技術で改良、改善を重ね、高品質な医薬品を安定的に供給いたします。
- 最新の科学的知見に基づくプロアクティブな取り組み及び積み上げてきた知識管理を基に、常に継続的改善を実施します。
東和薬品は、自社で定めた品質方針に基づき、根本から責任ある品質管理を追求し、確かな品質の医薬品を生産することに努めています。
製造管理・品質管理、安定供給への取り組みについて動画でご紹介
より高いレベルで東和薬品の医薬品をお届けするために
医薬品の製造には、国が定めたGMP(医薬品及び医薬部外品の製造管理及び品質管理の基準)が基本にあります。 これは、誰が、いつ作業しても必ず同じ品質・高い品質の製品をつくるために医薬品製造業者が守るべきルールです。
各製造所において、GMP三原則を遵守した手順を設定。社員には継続して教育訓練を行い、 一人ひとりが医薬品製造に携わる者としての高い意識を持って業務にあたるよう、日々取り組んでいます。
さらに、より厳しいルールの中で正しいものを作り出すために、国際的基準であるPICS/S GMPやICHガイドラインも積極的に取り入れ、人為的な誤りをより排除できる体制を構築しています。なお、山形工場において国際基準への適合状況を確認するため、外部機関(元 FDA 査察官)による模擬監査を実施しました。 その結果、国際基準に適合することを確認し、他工場への展開も行っています。
製造販売業としての管理監督・連携体制
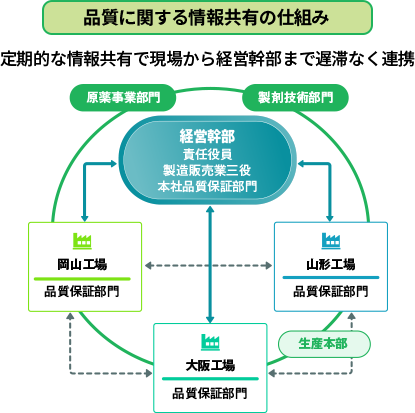
現在、東和薬品が取り扱っている約770品目すべての医薬品を徹底した品質管理のもとでお届けするために、現場から経営幹部まで遅延なく情報が共有される仕組みを構築しています。 経営幹部は実際に生産現場を確認し、各工場での定例報告会に積極的に参加しています。また、遠隔でいつでも現場の状況を把握できるように24時間カメラも設置しています。製造販売業三役(医薬品総括製造販売責任者、品質保証責任者、安全管理責任者)は毎月実施する三役会議にて、製造所から 品質保証責任者を通して情報共有を行い、指示ができる体制としています。また、品質管理の意識向上と絶え間ない改善のために、原薬事業部門・製剤技術部門と3つの工場で品質に関する情報共有や事例研究を行っています。これらの実行により、経営幹部から製造現場まで組織全体にわたって品質管理の意識の統一と連携を図っております。
マスターコントロール導入による品質管理体制の質的強化
東和薬品は、自社医薬品の製造・品質に関する情報の信頼性のさらなる向上と、これまでの製品開発で得た様々な知識を有効に活用することを目的として、品質マネジメントシステム“MasterControl Quality Excellence (Qx)” (以下、MCシステム)を導入することを2024年1月に決定し、運用に向けて様々な取り組みを進めてきています。
MCシステムは医薬品の製造・製造販売に係る品質イベント管理(逸脱処理、変更管理)や、開発段階から終売に至る医薬品のライフサイクルの各段階で得られる情報を統合して管理でき、なおかつData Integrityの保証下でのトラッキングが可能なシステムです。
2024年8月、生産部門にてMCシステムによる品質イベント管理の運用を開始し、文書管理の電子化についても推進しています。
現在、製品の開発段階についても同様の品質イベント管理を適用すべく、2025年2月より治験薬GMP(Good Manufacturing Practice)までをカバーして運用を開始します。さらに、2025年度内を目途に教育訓練管理システムを導入して運用開始することを計画しています。その後、グループ会社にても同じシステムを導入することで、東和薬品グループ全体での品質管理体制を一元的に強化していく予定です。
将来的には、MCシステムを生産現場でのMES(製造実行管理システム)やLIMS(試験情報管理システム)と連携させることや蓄積された品質に関する情報を整理し、知識として活用することで、類似事象の抽出や原因調査から対策までを迅速化、さらには開発段階から商業段階への技術移管に活用する等、東和薬品グループの業務革新にも貢献するシステムとなることが期待されています。
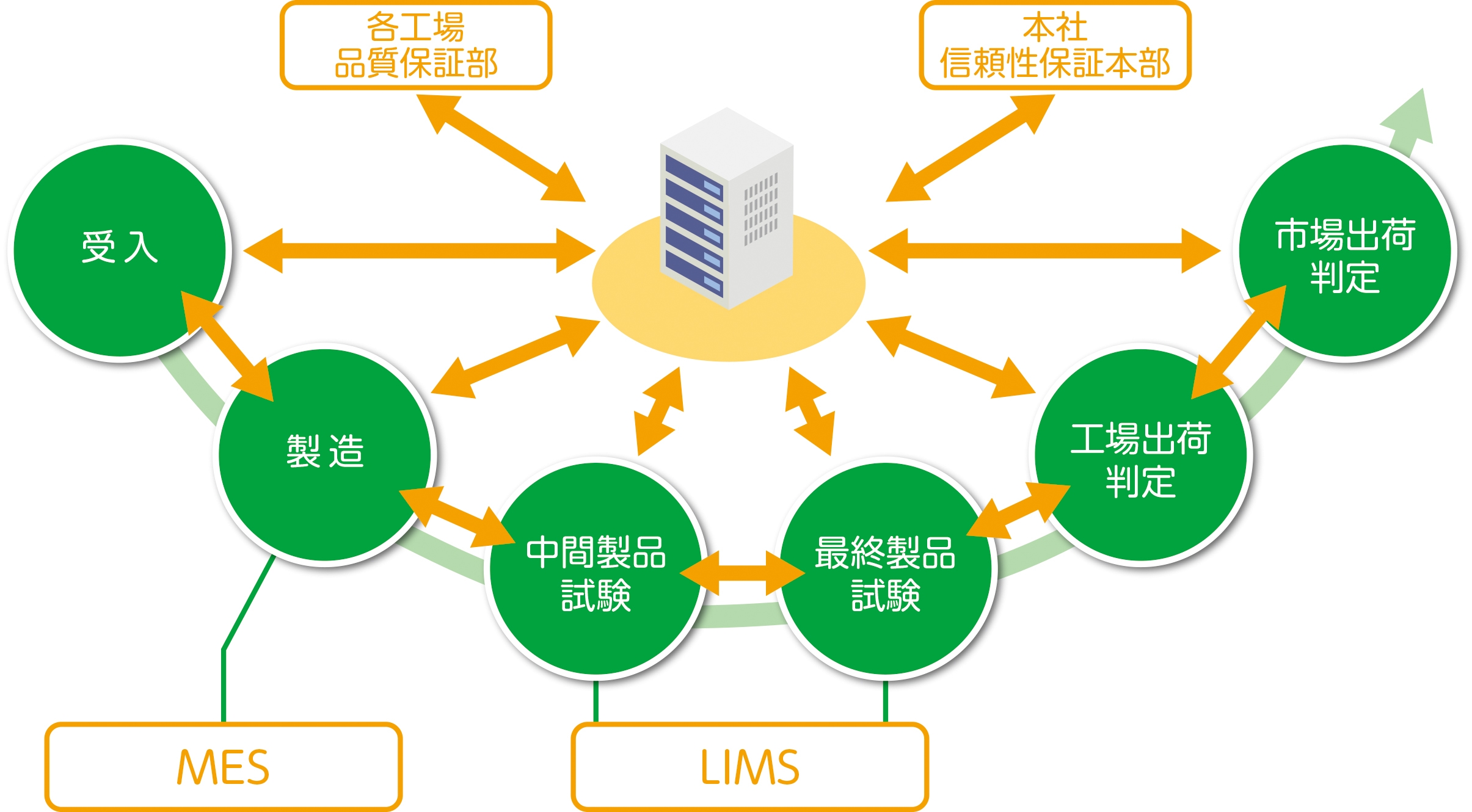
 |
製造専用および試験専用の既存システムにより原料受入~市場出荷までのデータを記録・管理 |
 |
マスターコントロールにより医薬品の製造・製造販売に係わるイベント管理や文書管理も含め、電子的に一元管理 |
教育訓練とシステム導入
医薬品製造に携わる者として高い意識をもつ人材を育成
継続的な教育訓練と独自の承認書マニュアル
GMP全般に関する教育、各担当分野における教育訓練を計画的に毎月1回実施しています。異動時には、新たに担当業務に関する教育を行い、適切な製造業務が行えるよう管理体制を敷いています。さらに、コンプライアンス遵守のために、上記とは別に年1回教育訓練を全社員を対象に実施しています。また、承認書の記載内容と製造実態に齟齬を生じさせないために、製造時に遵守すべき承認書の記載内容と、その背景にある薬事的要求事項を記載したマニュアルを作成しています。承認書通りに製造することの重要性を理解するための教育訓練を製造部門、技術部門等の関係部門に実施しています。
社内独自のエキスパート認定制度

通常の教育訓練に加え、製造・包装・試験・品質保証といった各部門で、より高い技術や知識を持つ者を「エキスパート」として認定する独自の制度を導入しています。これにより、各分野におけるスペシャリストが製造管理、品質管理を行える仕組みにすると同時に、品質確保に対する高い意識を持った社員の育成を推進しています。
MESやLIMSを積極的に導入 さらに作業者によるダブルチェックも徹底
人為的な誤りを最小限にするための取り組みとして、製造工程の管理や作業者への指示などをコンピューターがサポートする製造実行管理システム(MES)や、医薬品の品質試験を統括管理する試験情報管理システム(LIMS)の導入を行っています。これは人為的な誤りが起きる可能性のある手順を減らすことが目的です。さらにシステムと並行して複数の社員によるダブルチェックも実施し、多彩な品目で製造工程ごとのきめ細やかなチェックを機能させ、人為的な誤りをより排除する体制を築いています。
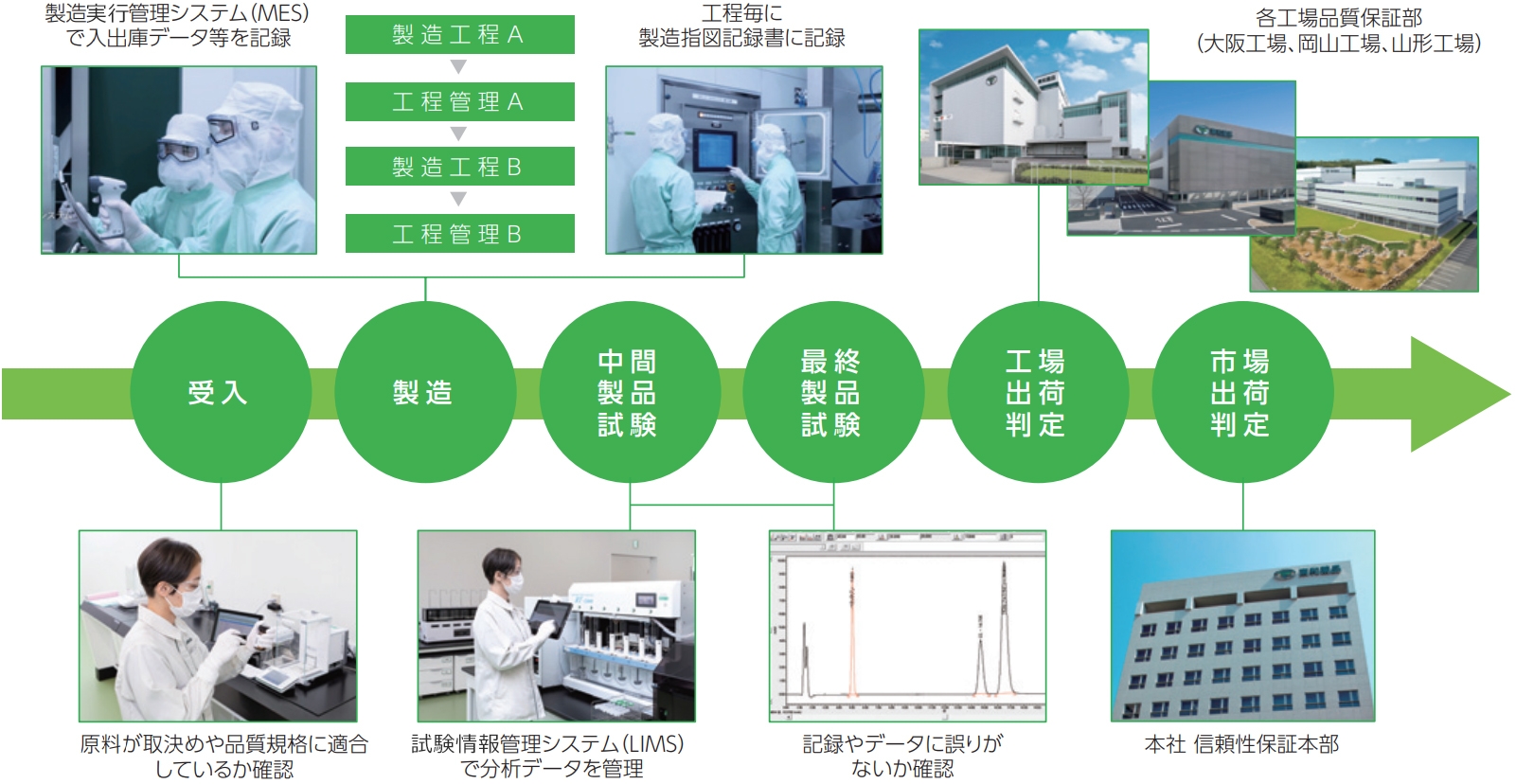
製造実行管理システム MES(Manufacturing Execution System)

MESとは、製造工程の把握や管理、作業者への指示や支援などを行う「製造実行管理システム」のことです。原材料(原薬・副原料・資材)及び工程ごとの中間製品をID管理し、不適合品や試験中の原材料や中間製品をシステム的にロックします。適合をもって初めてロック解除され、次工程に進む仕組みです。また、原材料及び中間製品の収支管理は、それぞれの工程ごとにバーコードを読み込んでシステムで照合するため、誤って別の原材料や中間製品が使用されることを防止します。システムによって管理されているため、人による改ざんや誤記入がなく、製造工程における原材料・中間製品の仕込み間違えや数量の人為的な誤りを抑えることが可能となります。
試験情報管理システム LIMS(Laboratory Information Management System)

LIMSとは、ネットワークなどを介して分析結果が分析機器から直接システムに入力されるなど、試験業務を統合管理するシステムのことです。MESは、LIMSと連携し効力を発揮しています。試験の開始時には、検体や試薬、試験機器に貼付されたQRコードを読み取るため、人による改ざん及び誤記入の防止につながります。また、試験操作及びデータの一連のすべての情報はシステムで保管・管理され、データの消去や改ざんすることはできません。さらに、規格外品の発生により再試験を実施する際は、再試験を採用した根拠及び責任者による認証が必要となり、それらの記録もすべてシステム内に保管され不正を察知することが可能です。
オートメーション化の推進
より的確な生産を、合理的に行うため、様々な作業において可能な限りオートメーション化するよう取り組んでいます。例えば、製造設備への品目ごとのレシピ(製造条件)登録です。 これにより、作業者はレシピを選択することで製造条件の設定が可能となり、作業者による設定間違いや作業の誤差を減らしています。レシピは品質部門が管理し、 作業者は変更できない仕組みになっています。包装工程では、PTPシートの成型から最終製品を段ボールへ梱包するまでの操作を、人を介さず機械が実施する設備を導入しています。 この他、3工場で統一した機械の導入、生産ラインの自動化を積極的に行い、オペレーターにやさしい作業環境を作ることも重要であると考え、対応を進めております。
品質確保の歴史
GMPを取り巻く環境の変化に迅速かつ的確に対応

これまでのGMPを取り巻く環境を振り返ると、2005年の改正薬事法により製造販売承認申請書への記載事項が大幅に追加されました。従来の製造承認申請書は製剤の処方及び品質規格を重視した内容でしたが、改正薬事法による製造販売承認申請書においては、これに加え原薬や製剤の製造所や製造方法、工程管理などを詳しく記載することを求められました。また、新たに申請するものに限らず旧薬事法で既に製造承認を受けていた全ての品目についても、改正薬事法の製造販売承認書の内容に記載整備する事を厚生労働省より求められ、製造販売元において製品の品質について責任を負う体制を整えていることが義務づけられました。以前の承認書の製造方法の記載はごく簡単なものでしたが、品目ごとに詳細な製造方法を記載することが必要とされたため、バリデーションで検証された製造方法について、1品目ずつ品質のチェックを行いながら薬事的要求事項を満たす記載整備を進めてきました。その後、2013年に改訂GMP施行通知、2014年には日本のPIC/Sへの加盟、2016年には「製造販売承認書と製造実態に関する一斉点検」が行われ、また、2021年にはGMP省令が改正され、製造管理において継続的改善が求められる法令整備が進められています。当社ではこれらGMPに関する変遷に際し、その重要性を深く認識し迅速かつ的確に対応することに尽力してきました。今後も医療関係者や患者さんに安心して当社のジェネリック医薬品を使用して頂けるよう、引き続き適切な製造管理・品質管理を行っていきます。
 医療関係者向けサイト
医療関係者向けサイト