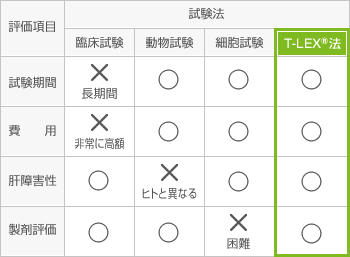
「T-LEX®法」(薬剤性ヒト肝障害リスク予測法)
ジェネリック医薬品の信頼性向上の取り組みとして、T-LEX®(Toxicity of Liver EXamination)法を開発しました。この評価方法は東和薬品が世界で初めて開発したものです(*)。
背景
ジェネリック医薬品は生物学的同等性試験によって有効性・安全性が先発医薬品と同等と保証され、承認を得ています。しかしながら、添加剤がジェネリック医薬品と先発医薬品で異なることなどで安全性に関して不安の声を伺うことがあります。安全性を評価する方法には製造販売後調査や臨床試験がありますが、販売開始時までに十分な規模の臨床試験を実施し評価することは困難です。
東和薬品では、これらの課題を解消するため、薬剤性の臓器障害で最も多い肝障害に着目し、T-LEX法を開発しました。T-LEX法では販売開始時までにジェネリック医薬品と先発医薬品の肝障害リスクの比較が可能です。
特徴
- ヒト肝細胞キメラマウスとトキシコゲノミクスの手法を用いることにより、ヒトの肝障害リスク予測が可能です。
- 製剤を投与するため、医薬品丸ごとの評価、様々な剤形での評価が可能です。
- ヒト臨床試験に比べて比較的安価かつ短期間でリスク予測が可能です。
方法・結果(アトルバスタチン製剤の事例)
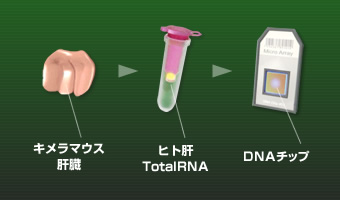
- ヒト肝細胞キメラマウス(PXBマウス®:株式会社フェニックスバイオ)に アトルバスタチン錠10mg「トーワ」もしくは先発医薬品を投与します。
- 各製剤投与群とコントロール群(医薬品非投与)の遺伝子発現量を調べます。(遺伝子発現量は、キメラマウスのヒト肝臓を摘出し、肝TotalRNAからcRNAを調製し、DNAチップを用いて調べます)
- 各製剤投与群とコントロール群の遺伝子発現量の比を算出し、以下(1)、(2)を行います。
- ヒト肝臓における遺伝子発現量の変動率を比較します。
- ヒト肝障害関連のPathwayの相関係数(r)を求めます。
両製剤投与時の遺伝子発現変動に高い相関性が示されました。(r = 0.95)
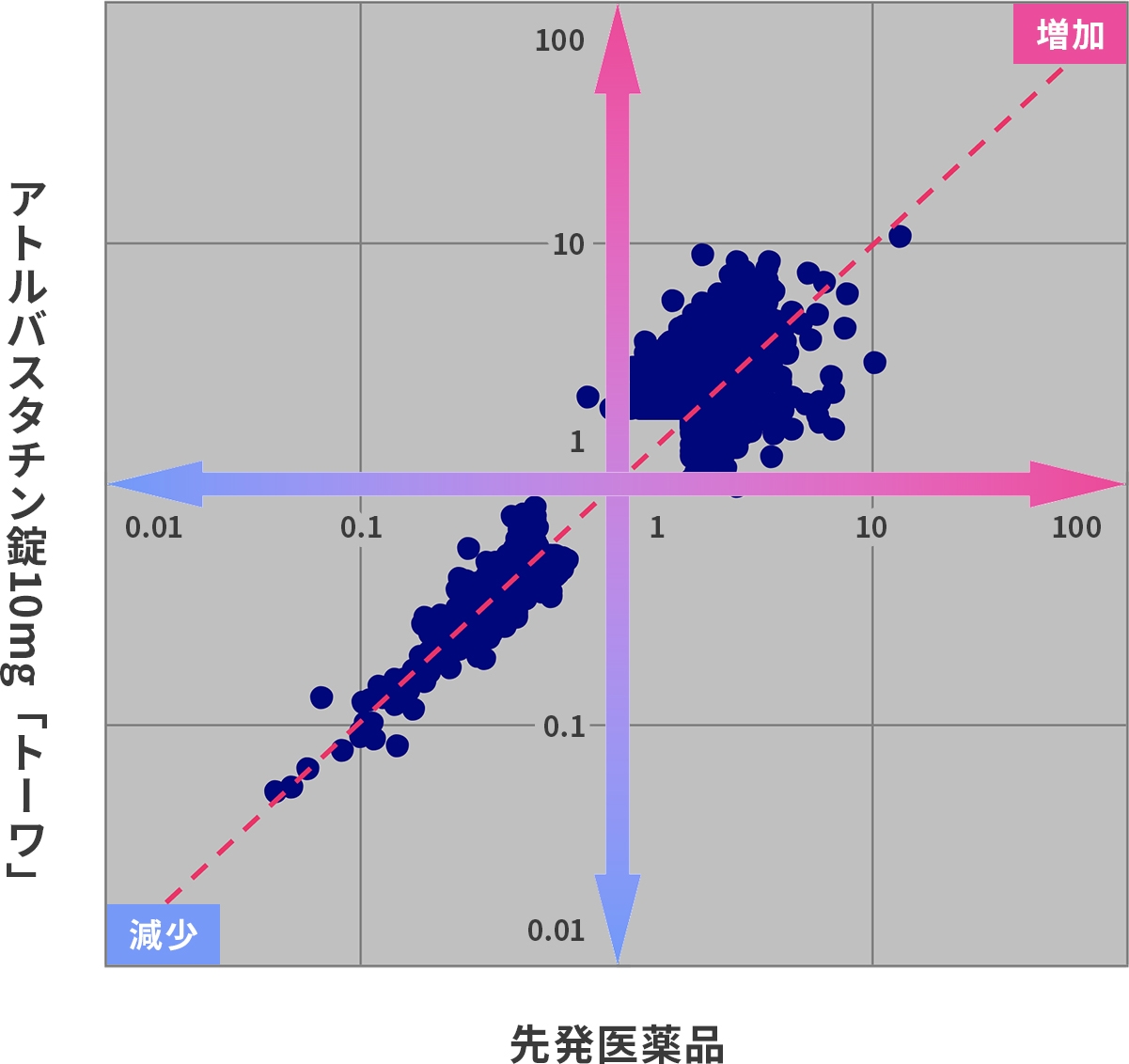
両製剤投与により同程度の遺伝子発現量の変化を示しました。(r ≧ 0.75)
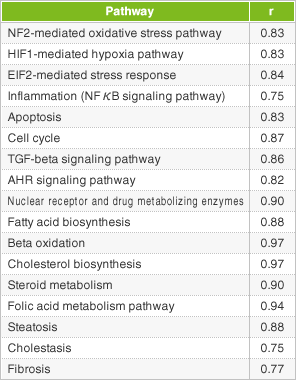
アトルバスタチン錠10mg「トーワ」と先発医薬品は、(1)、(2)の結果より、ヒト肝障害リスクが同程度であると推測されました。
*本研究は、長崎大学大学院医歯薬学総合研究科、積水メディカル株式会社、株式会社フェニックスバイオとの共同研究として、文部科学省科学研究費補助金の助成を受けて実施されました。
T-LEX®法は、長崎大学大学院医歯薬学総合研究科 中嶋幹郎教授および東和薬品株式会社の登録商標です(商標登録第5617856号)。
DC-004229_01
 医療関係者向けサイト
医療関係者向けサイト