バンコマイシン点滴静注用0.5g「トーワ」
塩酸バンコマイシン点滴静注用0.5gのジェネリック医薬品
-医療従事者の利便性を考慮した製剤-
2022年5月 処方変更により溶解性を改良し、使用期限を延長
<医療現場からのお声を製品づくりに>
東和薬品では、医療現場からいただいたお声をもとに分析と検討を重ね、製品づくりに活かしていく取り組みを行っています。
皆様に安心してお使いいただける製品を提供することを目指し改良・改善を進めていくことに努めています。
溶解性を改良
- 【溶解性試験1)】
-
- 試験方法
-
バイアルに各溶解液10mLを注入後、注射針をゴム栓から抜き、溶解するまで手で振とうする。手で振とうを始めた時点を0秒とし、目視にて内容物の塊が確認できなくなった時間を測定。
※手で振とう 振幅:約10cm / 速さ:約4秒以内に10往復振とう - 結果
-
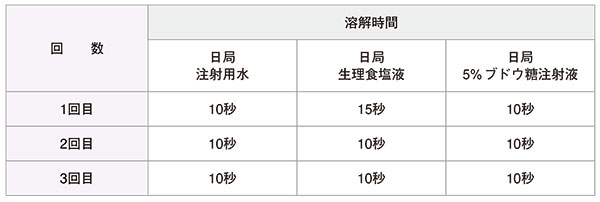
生理食塩液の1回目以外の全ての溶解液において、5秒時点では気泡程度の細かな内容物が残っていた。7~8秒時点でも目視確認可能であったが、10秒時点では全て溶解していた。
生理食塩液の1回目においては、数mm程度の内容物の塊があった。塊の周りに気泡が付着しており振とうを繰り返しても気泡が離れず、溶解が進まなかったが、15秒程度で溶解した。
以上より、各溶解液において、残留等なく15秒以内に溶解したことを確認した。 - (参考情報)バンコマイシン点滴静注用0.5g「ト-ワ」 溶解時間 新処方と旧処方製剤との比較
-
旧処方製剤においても同様の試験方法にて試験を実施しており、本試験の結果との比較を下記の表に示した。
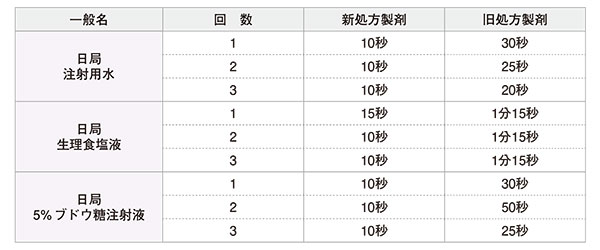
1)社内資料 バンコマイシン点滴静注用0.5g「トーワ」の各種溶解液での溶解性試験
*本試験は一部変更承認申請時の照会事項に対する回答として提出し了承された資料です。
使用期限を3年に延長
- 【加速試験2)】
-
- 結果
-
包装形態:透明ガラスバイアルに入れた製品
試験条件:40℃、75%RH、3ロット(n=3)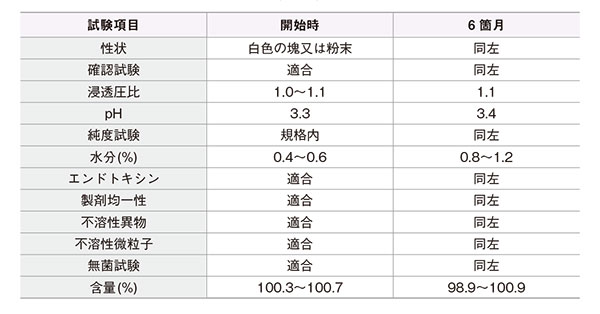
最終包装製品を用いた加速試験(40°C、相対湿度 75%、6箇月)の結果、バンコマイシン点滴静注用0.5g「トーワ」は通常の市場流通下において3年間安定であることが推測された。
2)医薬品インタビューフォーム
 医療関係者向けサイト
医療関係者向けサイト