エフィナコナゾール爪外用液10%「トーワ」
クレナフィン爪外用液10%のジェネリック医薬品
-医療従事者と患者さんのニーズを考慮した製剤-
第Ⅲ相試験(爪白癬症患者を対象)で治療学的同等性を確認
爪白癬患者を対象にした有効性評価により治療学的同等性を確認
- 【エフィナコナゾール爪外用液10%「トーワ」の生物学的同等性1)】 ■爪白癬症患者を対象とした無作為化単盲検並行群間比較試験(第Ⅲ相試験)
-
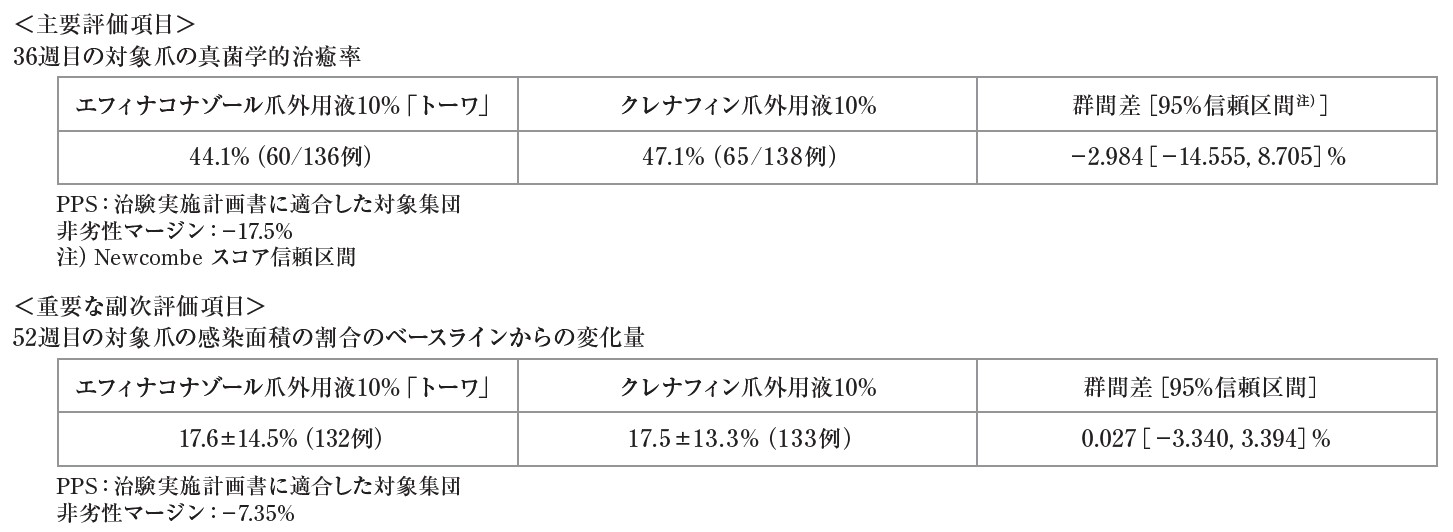
感染面積が20~50%の皮膚糸状菌(Trichophyton属)による爪白癬症患者307例を対象に、エフィナコナゾール爪外用液10%「トーワ」(試験製剤)又はクレナフィン爪外用液10%(標準製剤)を、感染趾爪に1日1回48週間塗布する無作為化単盲検並行群間比較試験を実施した。投与36週目の対象爪の真菌学的治癒率及び投与52週目の対象爪の感染面積の割合のベースラインからの変化量は以下の表のとおりであり、いずれの評価項目においても、群間差の95%信頼区間の下限は、事前に設定した非劣性マージンを下回らなかったことから、両剤の治療学的同等性が確認された。

<安全性の評価>
副作用発現頻度はエフィナコナゾール爪外用液10%「トーワ」群で14.8%(23/155例)であった。
主な副作用は、適用部位皮膚炎11.0%(17/155例)、適用部位肥厚1.9%(3/155例)、爪甲剥離症1.3%(2/155例)等であった。
<全身曝露量>
エフィナコナゾール爪外用液10%「トーワ」群21例で、投与前及び12週ごとに血漿中エフィナコナゾール濃度を測定した。
全測定時点において血漿中エフィナコナゾール濃度の90%信頼区間上限値は、事前に設定した許容限度(6ng/mL)を上回らず、
エフィナコナゾール爪外用液10%「トーワ」の薬物曝露量がクレナフィン爪外用液10%を上回らないことが確認された。
1)出典:佐藤友隆ほか:新薬と臨牀.2025;74(10):977-991
本試験は東和薬品株式会社が実施し、論文の著者には同社の社員が4名含まれます。
医療従事者と患者さんの利便性を考えたデザイン
- 細かな患部への塗りやすさを考慮し、先端をペン型の形状で開発
- 平面を含んだ転がり防止キャップ
- QRコードを表示(服薬指導箋にアクセスできます)
- 誤調剤防止のため、1本の内容量である「3.56g」を大きく表示

QRコードは(株)デンソーウェーブの登録商標です。
 医療関係者向けサイト
医療関係者向けサイト